Your basket is currently empty!
Evaluating Immunogenicity risk of Complex peptide products (Chinese)
评估仿制药肽产品的免疫原性风险

评估仿制药肽产品的免疫原性风险
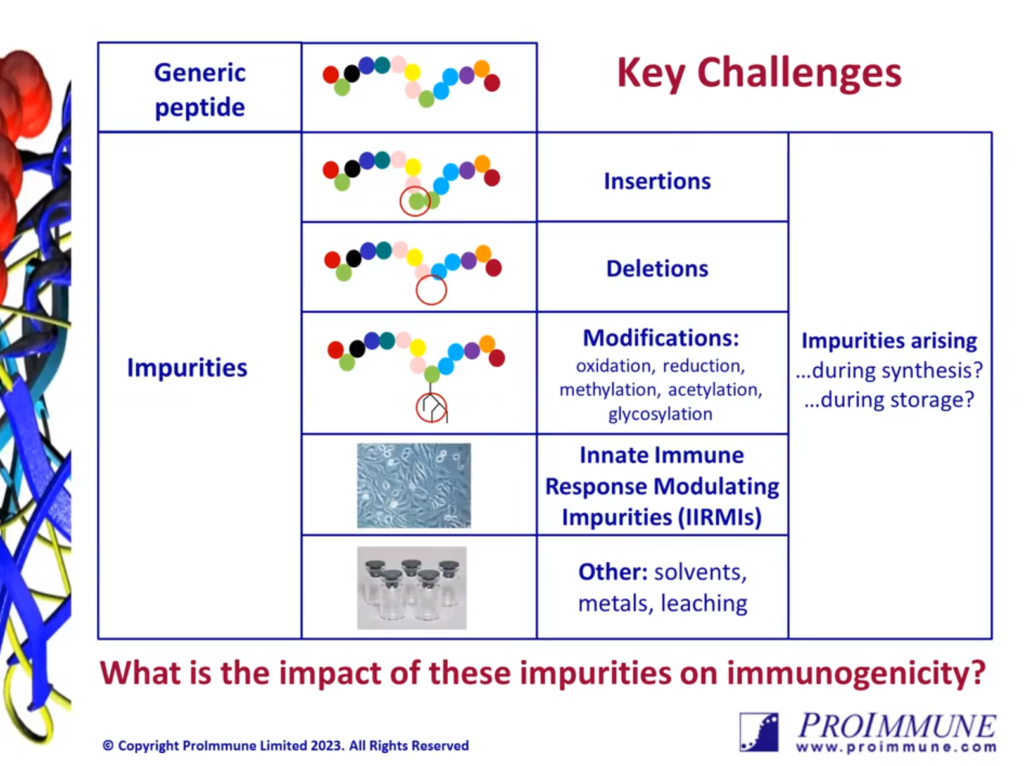
复合肽药物可以通过重组或合成制造工艺生产。在开发新型或通用肽时,开发人员必须证明药物产品中存在的任何杂质(这些可以是宿主细胞衍生的、直接与肽相关的杂质(即截短或插入的氨基酸)或其他非肽相关的杂质)杂质)不会造成可能导致原料药免疫原性的免疫激活风险。
在涉及通用肽(如胰高血糖素、利拉鲁肽、特立帕肽、替度鲁肽、奈西立肽等)的情况下,开发人员有责任证明:
- 对于在参考目录药物 (RLD) 和仿制药肽中发现的每种肽相关杂质,合成肽中的杂质水平不高于 RLD;
- 仿制药肽中新杂质含量不超过原料药0.5%;
- 对于存在的此类杂质,可以提供理由说明为什么与 RLD 相比,该杂质不会影响通用肽的安全性,包括免疫原性。
对于此类通用肽的开发人员来说,这可能是一个令人生畏的前景,因为提供这种证据所需的技术能力通常在内部不可用。随着我们知识的深入,监管要求不断发展,您需要与值得信赖的合作伙伴合作。 ProImmune 在这一特定领域拥有超过 10 年的经验,我们将在快速的时间内以全球监管机构定期审查的格式为您提供高质量的可靠数据。
了解与 ProImmune 合作将如何加速您对仿制药肽产品的监管审批:
评估先天和适应性免疫原性风险有两个关键组成部分。
先天免疫原性风险评估
先天免疫反应是人体抵御病原体的第一道防线,通常是快速的。在肽相关或工艺相关杂质的背景下,风险在于这些杂质可能会触发抗原呈递细胞上的模式识别受体 (PRR),从而激活先天反应途径,导致细胞活化、细胞因子的产生和启动适应性免疫反应。这是产品免疫原性的标志。
在 ProImmune,我们部署了 ProStorm® 细胞因子释放检测来评估这种风险。这是一种新鲜的全血检测,由经过培训的抽血医生从一组健康志愿者中抽取血液,专门用于您的研究,然后在抽血后仅 3 小时内与测试材料一起孵育。在 24 小时的潜伏期后,血浆中与先天免疫激活相关的一组 7 种细胞因子被量化。在您的肽药物存在的情况下,证明该检测的适当灵敏度非常重要。为此,我们将一系列浓度的先天免疫反应调节杂质 (IIRMI) 加入样本子集。这些 IIRMI 是不同 PRR 的激动剂,通常包括 TLR2、TLR4、TLR5、TLR6、TLR7、TLR8、Dectin-1 和 NOD2。确认负责响应这些杂质的细胞(例如树突状细胞)的活力也很重要,因此我们还可以在研究中对此进行流式细胞术验证。
通常,在该测定中比较多批次(最少 3 个)通用和 RLD 肽。考虑不同的 API 批次、批次到期日期以及地理批次放行等因素也很重要。
作为评估复杂仿制药肽免疫原性风险的专家,ProImmune 很荣幸作为主题专家参加最近由美国 FDA 和复杂仿制药研究中心 (CRCG) 联合主办的研讨会。ProImmune 销售总监 Jeremy Fry 博士概述了 ProImmune 验证新鲜全血检测的综合流程。这包括建立细胞因子面板、生成标准曲线、定义检测验收标准(例如定量的上限和下限)以及确认信号恢复和检测变异性。
ProImmune 的 ProStorm 细胞因子释放检测已作为药物主文件 (DMF) 提交给 FDA,简化了您的简化新药申请 (ANDA) 的参考流程。
适应性免疫原性风险评估
肽相关杂质可能由氨基酸序列组成,这些序列无意中对 MHC 分子(I 类或 II 类)具有更高的亲和力。如果 MHC 呈现的肽杂质随后在适当的共刺激背景下被同源 T 细胞受体识别,则 T 细胞适应性免疫反应将被激活。这会导致显著的免疫原性。
ProImmune 能够提供一系列正交方法来评估这些适应性免疫原性风险的不同元素。第一个是功能性 ProMap® T 细胞增殖测定,该测定在 7 天内使用流式细胞仪读数测量一组不同的健康供体 PBMCs 中的 T 细胞增殖,这些 PBMCs 用 CFSE 标记,在添加单个杂质和 API 后,以不影响 APC 活力的最大等摩尔浓度进行测试。ProImmune 的 ProMap T 细胞测定已作为 DMF 提交给 FDA,简化了您的 ANDA 的参考流程。
另一种方法是 ProImmune REVEAL® MHC-肽竞争结合试验,其可以通过确定单个杂质和 API 的抑制浓度 50% (IC50) 来评估结合亲和力,通常在 12 个浓度的滴定范围内针对一组 MHC II 类等位基因进行测试。
在最近由美国 FDA 和 CRCG 联合主办的研讨会上,ProImmune 高级免疫学销售专家 Emilee Knowlton 博士介绍了我们的 ProPresent® 抗原呈递 MAPPS 检测方法,以评估 API 和杂质中的肽呈递情况,并详细介绍了使用 MAPPS 检测方法作为肽免疫原性评估正交方法的实验设计考虑因素。

如果您想要所描述的任何检测的样本报告副本,或者想要以保密方式讨论您自己的项目要求的技术细节并收到成本建议书,请随时联系我们的免疫学专家团队将很高兴为您提供帮助。
可在此处找到 FDA “某些高度纯化的合成肽药物产品的 ANDA 指代 rDNA 来源上市药物”的完整指南:https://www.fda.gov/media/107622/download
